Nukleosidtriphosphat-Derivate von Favipiravir-Analoga als potente und breit wirkende Virostatika
Das Nukleobasenanalogon (Nb*) Favipiravir (T-705) ist ein vielversprechender Ausgangspunkt für die Entwicklung breit wirkender antiviraler Wirkstoffe, da es eine Aktivität gegen zahlreiche RNA-Viren gezeigt hat. Allerdings erwies sich die Nukleosidform dieses Analogons als chemisch instabil (Huchting et al. ChemMedChem 2017 ).
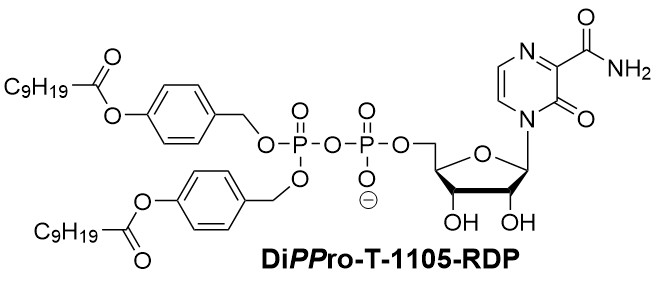
T-1105, die nicht fluorierte Version von T-705, hat eine günstige chemische Stabilität und eine größere antivirale Wirksamkeit in Madin-Darby Canine Kidney (MDCK)-Zellen (Huchting et al. ChemMedChem 2017; Huchting et al. J. Med. Chem. 2018; Huchting et al. Antiviral Res. 2019). In anderen Modellen erwies sich dieses Analogon jedoch aufgrund von metabolischen Engpässen im Aktivierungsweg Nb* -> N*MP -> N*DP -> N*TP als weniger wirksam. Diese hängen von der chemischen Struktur von dem Nb* abgeleiteten Nucleotide und vor allem von dem Zelltyp ab, der für die Untersuchung der antiviralen Aktivität verwendet wird (Huchting et al. Antiviral Res. 2019).
Wir setzen daher unsere DiPPro- und TriPPPro-Technologie ein, um ineffiziente Kinasen der Wirtszellen zu umgehen und schließlich hohe Mengen an N*TP an ihr virales Ziel in infizierten Zellen zu bringen. Zum Beispiel hemmte DiPPro-T-1105-RDP das Influenzavirus mit einer 5-fach höheren Wirksamkeit als das Nukleobasen-Analogon T-1105 in Zellkultur (Huchting et al. J. Med. Chem. 2018). Darüber hinaus optimieren wir die chemische Synthese von N*TP, um ihre Eigenschaften gegenüber verschiedenen viralen RNA-Polymerasen zu untersuchen (Huchting et al. J. Med. Chem. 2018) und letztlich neue Nukleosidanalog-Triphosphate mit günstigen Eigenschaften als Kandidaten für breit wirkende Therapeutika gegen RNA-Virusinfektionen zu finden.