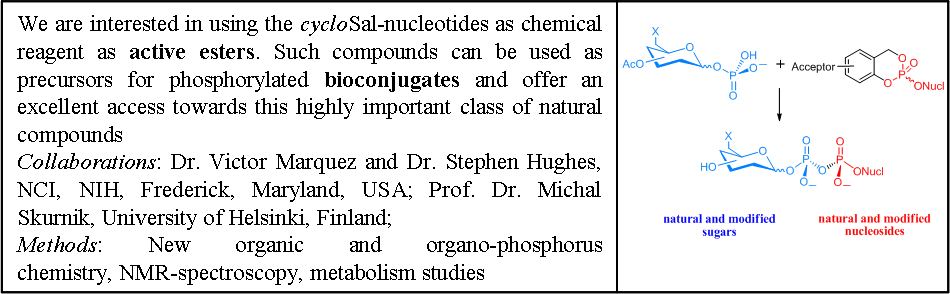CycloSal-Nukleotide als chemische Reagenzien
1. Hintergrund
Die Freisetzung eines Nukleosidmonophosphats aus einem CycloSal-Nukleotid basiert auf einem effizienten und hochselektiven chemischen Hydrolyseweg. Daher können CycloSal-Nukleotide auch als aktive Ester verwendet werden, um Zugang zu verschiedenen phosphorylierten Biomolekülen zu erhalten. Im Gegensatz zu anderen gebräuchlichen Pronukleotidkonzepten, die auf enzymatische Aktivierung angewiesen sind, wird die Spaltung der lipophilen Maske eines CycloSal-Nukleotids 1 durch nukleophilen Angriff von Hydroxid am Phosphattriester initiiert. Die Verwendung von anderen Nukleophilen als Hydroxid führt zur Bildung der folgenden Zielmoleküle:
I) nucleoside 5'-di- and triphosphates
II) nucleoside diphosphate sugars
III) nucleoside monophosphate sugars
IV-VI) dinucleoside polyphosphates
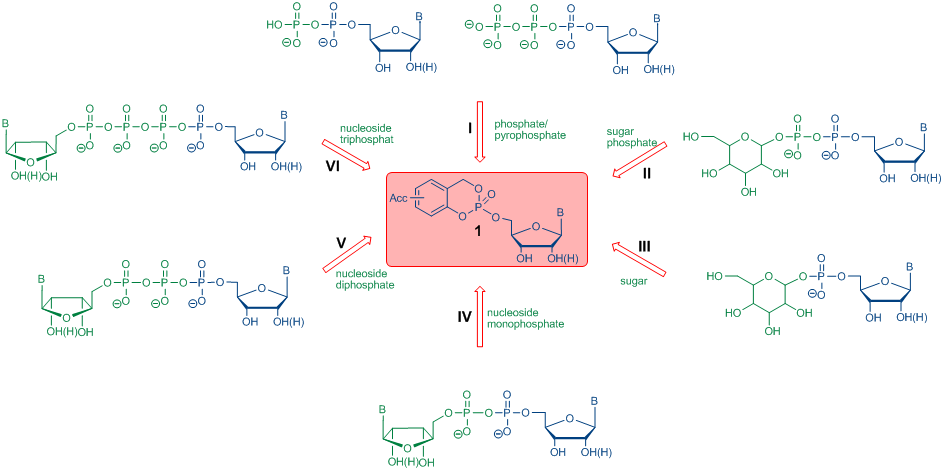 Schema 1: Synthese verschiedener phosphorylierter Biomoleküle unter Verwendung von CycloSal-Nukleotiden
Schema 1: Synthese verschiedener phosphorylierter Biomoleküle unter Verwendung von CycloSal-NukleotidenBei synthetischen Anwendungen von CycloSal-Nukleotiden als phosphataktive Ester werden akzeptorsubstituierte Verbindungen verwendet, um die Elektrophilizität des Phosphor-Zentrums zu erhöhen und als Folge davon die Anfangsreaktion, d.h. die Spaltung der phenolischen Phosphatesterbindung, zu beschleunigen (Schema 2, A). Anschliessend wird der Benzylphosphatdiester selektiv zum gewünschten Zielmolekül und nach wässriger Arbeit bis zum Salicylalkohol gespalten (Schema 2, B).
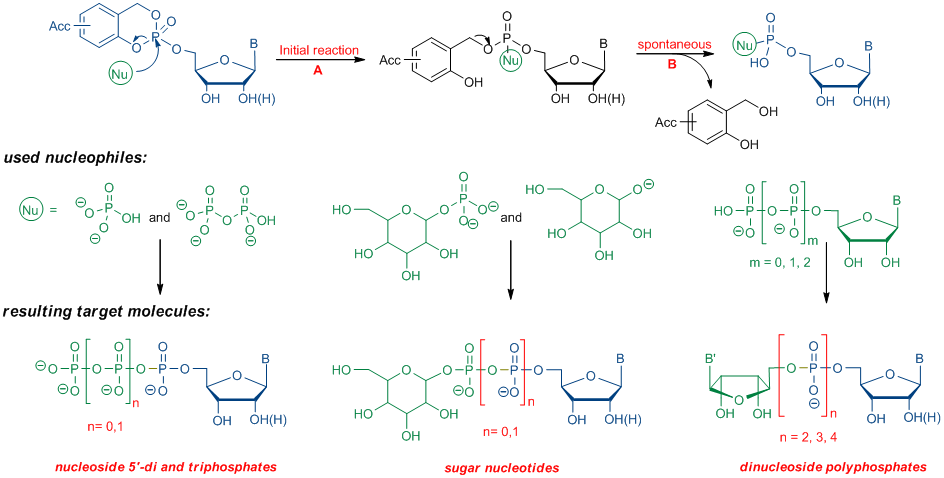 Schema 2: Nukleophile Spaltung von CycloSal-Nukleotiden
Schema 2: Nukleophile Spaltung von CycloSal-NukleotidenNeuerdings werden die in Schema 2 gezeigten Umwandlungen auch an der Festphase durchgeführt. Dazu wird ein CycloSal Phosphat-Triester zunächst mit einem Linker verbunden und anschließend an einen funktionalisierten Feststoffträger gebunden. Der Angriff eines gewünschten Nukleophils (siehe Schema 2) führt im Falle der quantitativen Umsetzung der Triester-Reinprodukte nach Abspaltung vom Feststoffträger zu Ergebnissen.
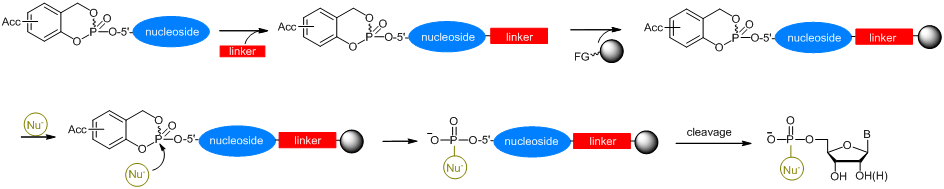 Schema 3: Feststoff-unterstützte Synthese von 5'-phosphoryliertem Biomolekül
Schema 3: Feststoff-unterstützte Synthese von 5'-phosphoryliertem Biomolekül
2. Biologische Bedeutung
a) von Nukleosid 5'-Triphosphat
Nukleosid-5á-Triphosphate (NTPs) stellen eine Klasse von sehr wichtigen Verbindungen in biologischen Systemen dar. Natürlich vorkommende NTPs dienen als Bausteine für die enzymatische Synthese von DNA und RNA. Darüber hinaus werden einige Analoga als Diagnostika und Therapeutika eingesetzt, z.B. als Chemotherapeutika. Darüber hinaus gibt es eine Vielzahl von Anwendungen von NTPs bezüglich der Strukturbestimmung von Nukleinsäuren, der Verwendung als Substrate für die DNA- und RNA-Sequenzierung und zur Markierung von Hybridisierungen. Aufgrund ihrer Bedeutung in vivo und in vitro ist eine allgemein anwendbare und effiziente Synthesestrategie für NTPs erforderlich.
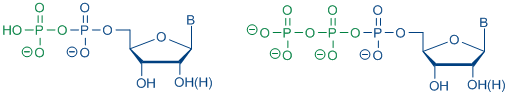 Schema 4: Strukturen von Ribo- und 2'-Desoxyribonukleosid 5'-Di- und Triphosphat
Schema 4: Strukturen von Ribo- und 2'-Desoxyribonukleosid 5'-Di- und Triphosphatb) von Nukleosiddiphosphat-Pyranosen
Viele Infektionen basieren auf gramnegativen Bakterien. Sie werden durch Antibiotika bekämpft, wobei die Möglichkeit eines Todes durch septischen Schock besteht. Die Zahl der Todesfälle bleibt konstant. Der septische Schock besteht aus der Lipoid-A-Verbindung des LPS, die als Endotoxin wirkt.
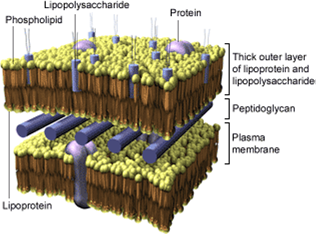 Schema 5: Schematische Darstellung einer Zellwand aus gramnegativen Bakterien
Schema 5: Schematische Darstellung einer Zellwand aus gramnegativen Bakterien
Darüber hinaus ist nach Zerstörung solcher Bakterien durch Antibiotika die hohe Menge an freigesetzten Lipopolysacchariden für die Entstehung des septischen Schocks verantwortlich. Daher ist es von großem Interesse, antibakterielle Wirkstoffe zu entwickeln, die keine Endotoxine freisetzen. Für diesen Ansatz ist ein adäquater Zugang zu Nukleosiddiphosphat-Glykopyranosen erforderlich.
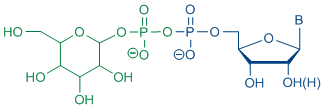
Artikel in der Zeitung "Die Welt" über Nukleosiddiphosphatzucker (21.04.2008): http://www.welt.de/welt_print/article1922164/Trojanische_Pferde_gegen_Krankheiten.html
3. Ausgewählte Publikationen
- S. Wendicke, S. Warnecke, C. Meier, Efficient Synthesis of Nucleoside Diphosphate Glycopyranoses, Angew. Chem. 2008, 120, 1523-1525; Angew. Chem. Int. Ed. 2008, 47, 1500-1502.
- S. Warnecke, C. Meier, Synthesis of Nucleoside Di- and Triphosphates and Dinucleoside Polyphosphates with cycloSal-Nucleotides, J. Org. Chem. 2009, 3024-3030.
- S. Wolf, T. Zismann, N. Lunau, C. Meier, Reliable Synthesis of Various Nucleoside Diphosphate Glycopyranoses, Chem. Eur. J. 2009, 15, 7656-7664.
- S. Wolf, T. Zismann, N. Lunau, S. Warnecke, S. Wendicke, C. Meier, A Convenient Synthesis of Nucleoside Diphosphate Glycopyranoses and Other Polyphosphorylated Bioconjugates, Eur. J. Cell Biol. 2010, 89, 63-75.
- V. C. Tonn, C. Meier, Solid-Phase Synthesis of (Poly)phosphorylated Nucleosides and Conjugates, Chem. Eur. J. 2011, 17, 9832-9842.
- S. Wolf, R. Molina Berrio, C. Meier, Synthesis of Nonnatural Nucleoside Diphosphate Sugars, Eur. J. Org. Chem. 2011, 6304-6313.
- N. Lunau, C. Meier, Synthesis of L-Altrose and Some Derivatives, Eur. J. Org. Chem. 2012, 6260-6270.
- S. Wolf, S. Warnecke, J. Ehrit, F. Freiberger, R. Gerardy-Schahn, C. Meier, Chemical Synthesis and Enzymatic Testing of CMP-Sialic Acid Derivatives, ChemBioChem 2012, in press.