Bekämpfung von Virusinfektionen und Krebs: Modifizierte Nukleosidtriphosphate als Polymerase-Inhibitoren
Für zahlreiche neoplastische Erkrankungen sind die verfügbaren Behandlungsmöglichkeiten unzureichend, so dass Krebs mit geschätzten 9,6 Millionen Todesfällen im Jahr 2018 weltweit die zweithäufigste Todesursache ist. Das Humane Immunschwäche-Virus (HIV) und das Hepatitis-C-Virus (HCV) verursachen globale Pandemien, die laut WHO jährlich etwa 940.000 (HIV im Jahr 2017) oder 400.000 (HCV) Menschenleben fordern. Darüber hinaus ist die rasche Entwicklung wirksamer Therapeutika erforderlich, um dem Auftreten und der Ausbreitung von Viren entgegenzutreten, die Epidemien von hämorrhagischem Fieber (z.B. Ebola-Virus), Dengue- und Zika-Fieber, Influenza ("echte Grippe") oder SARS/MERS auslösen. Ein prominentes Beispiel ist hier auch das zoonotische RNA-Virus SARS-CoV-2, welches die COVID-19-Pandemie (2019/2020) verursacht.
Angesichts dieser verheerenden Krankheiten liegt unser Schwerpunkt auf der Erforschung von Anti-Krebs-Medikamenten und Anti-Infektiva, um die Entwicklung neuer oder verbesserter Therapieoptionen anzustoßen und die globale Vorbereitung (preparedness) zur Behandlung von Infektionskrankheiten zu stärken, die durch (neue) virale Erreger ausgelöst werden. Unsere Forschung konzentriert sich auf zytostatische und antivirale Nukleosidtriphosphat-Analoga (N*TP), die die Genom-Replikation effizient hemmen und dadurch das Zellwachstum oder die Virusinfektion stoppen können.
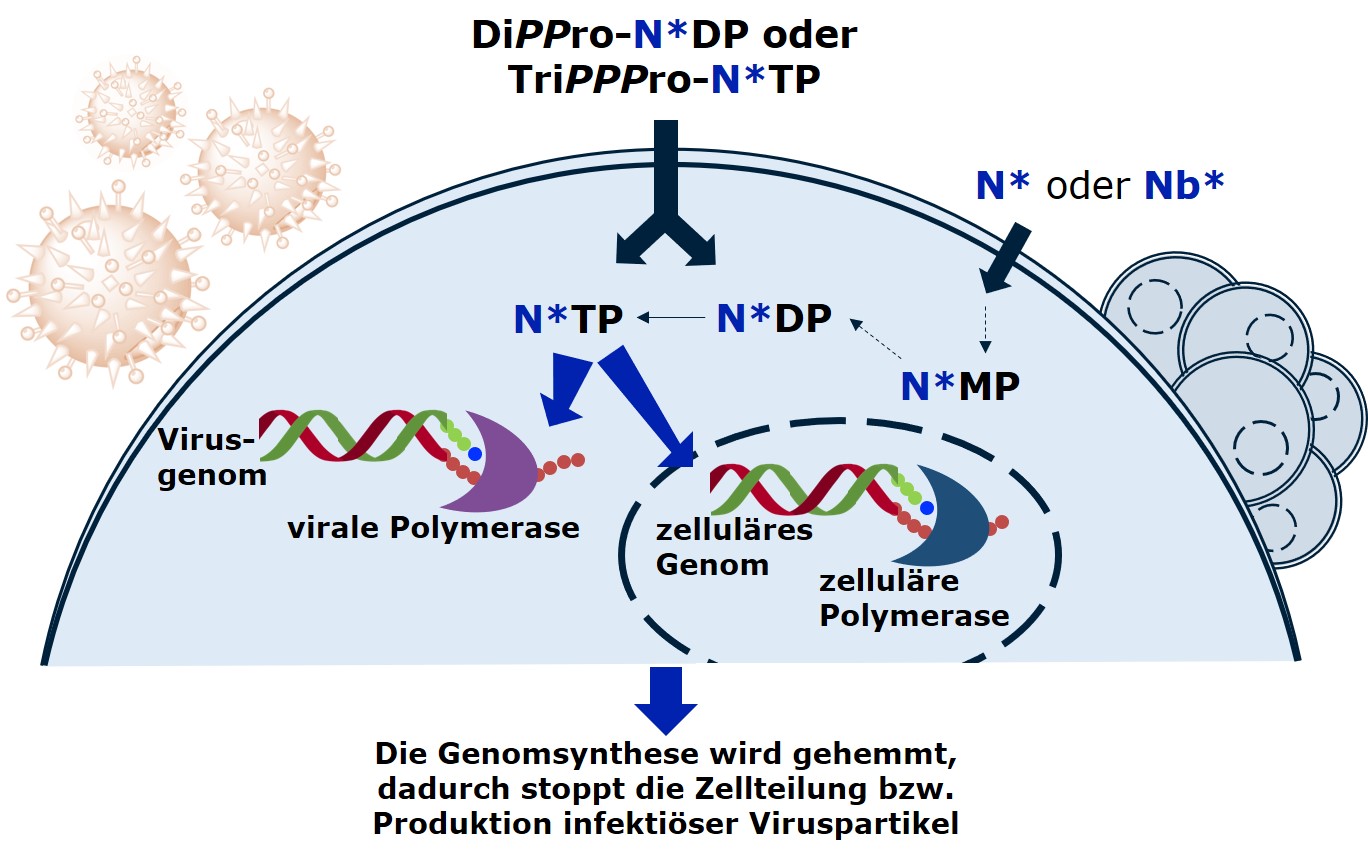
N*TP sind geladene Moleküle und können daher die Zellmembranen nicht durchqueren. Daher stehen ihre ungeladenen Vorläufer, die Nukleosidanaloga (N*) oder Nukleobasenanaloga (Nb*), traditionell im Zentrum der Medikamentenentwicklung. Um die Zielenzyme (zelluläre oder virale Polymerasen) zu hemmen, müssen N* und Nb* jedoch zunächst in den Zellen zu N*TP umgewandelt werden. Die Enzyme der Wirtszelle müssen diese Metabolisierung schrittweise ausgehend von N* oder Nb* über das entsprechende Nukleosidmonophosphat (N*MP) und -diphosphat (N*DP) durchführen, um schließlich aktives N*TP zu produzieren. Ungünstige Substrateigenschaften der Analoga verursachen metabolische Engpässe, die die intrazellulären N*TP-Spiegel und damit die Wirksamkeit der Verbindungen einschränken.
Mit unserer einzigartigen DiPPro- und TriPPPro-Technologie (siehe Publikationen) gelingt es uns, N*DP bzw. N*TP durch Zellmembranen zu schleusen. Dadurch überwinden sie die metabolischen Engpässe ,können im Vergleich zu N*- oder Nb*-Vorläufermolekülen eine verbesserte Wirksamkeit zeigen und so eventuell auch deren Abhängigkeit von jeweilig infizierten Zelllinie überwinden.
Maskierte Nukleosid 5'-Di- und -Triphosphate: Anwendung der DiPPro- und TriPPPro-Technologie für therapeutische Strategien gegen Virusinfektionen und Krebs