Wasser - Eine ungewöhnliche Verbindung

Wasser ist die Grundlage allen Lebens, unsere Erdoberfläche ist zu 71 % davon bedeckt, ein Großteil ist Salzwasser in den Meeren und Ozeanen. Aber auch der menschliche Körper besteht zu über der Hälfte (je nach Alter ca. 50-70 %) aus Wasser. Es liegt in der Natur generell selten rein vor, sondern enthält meist Salze, organische Verbindungen oder auch Gase. In seiner Reinform ist es farblos, geruchs- und geschmacksfrei.
Wasser ist außerdem die einzige chemische Verbindung auf der Erde, die als Flüssigkeit („Wasser“), als Festkörper („Eis“) und als Gas („Wasserdampf“) natürlich vorkommt (Abbildung 1), u.a. unser Klima und Wetter sind maßgeblich durch diese drei Aggregatzustände bestimmt. Der Tripelpunkt des Wassers, an dem die drei Phasen reines flüssiges Wasser, reines festes Wasser und Wasserdampf im Gleichgewicht stehen (Abbildung 2), liegt bei 273.16 K und 0.0061 bar und diente lange als Fixpunkt der internationalen Temperaturskala.
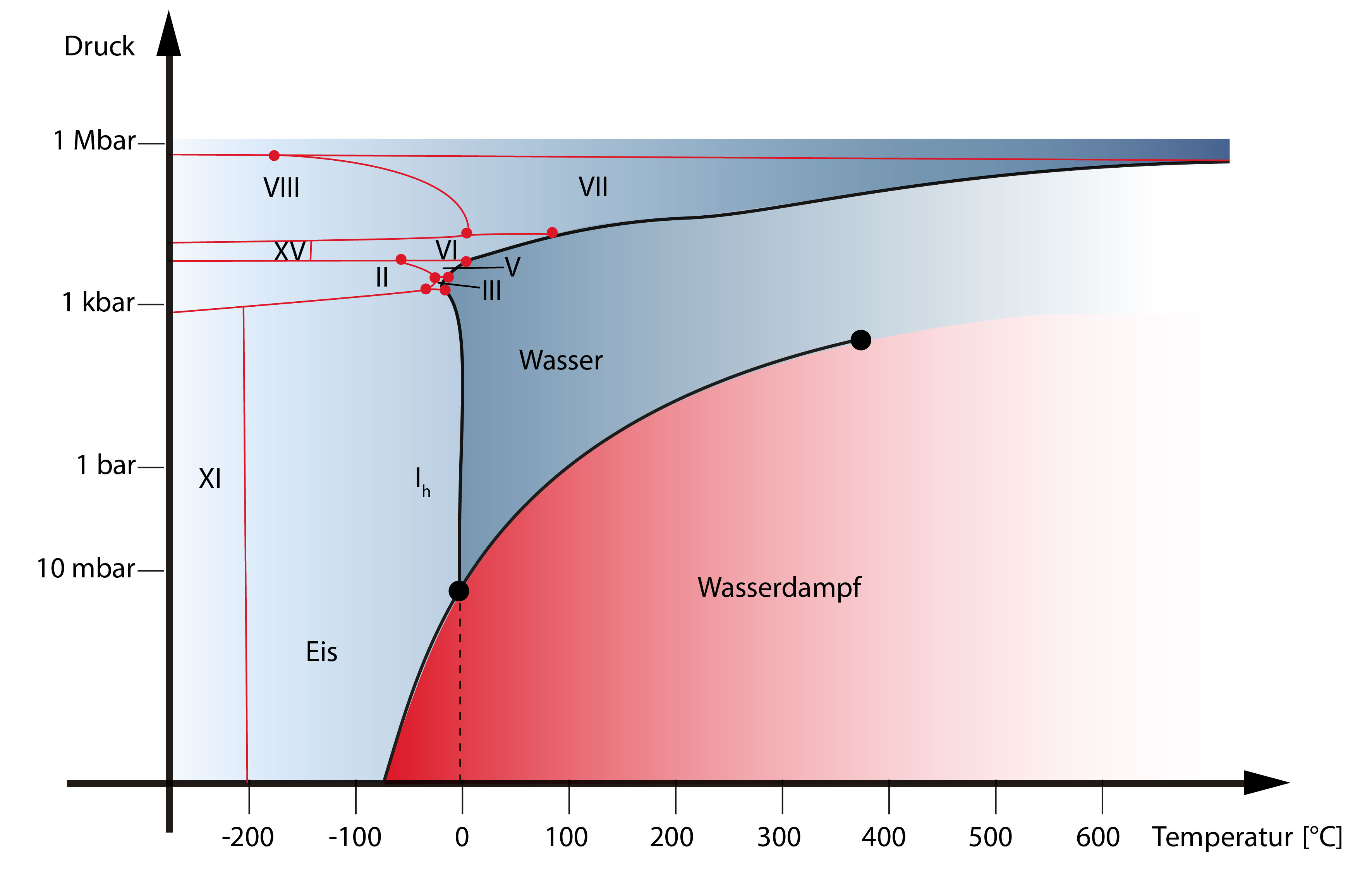
So mag Wasser zwar eine der bekanntesten und wichtigsten Substanzen auf dem Planeten sein, aber es ist sicher nicht gewöhnlich und seine Eigenschaften sind auch heute noch Bestandteil intensiver Forschung.
Bereits als Volumensystem weist Wasser im Vergleich zu anderen Fluiden besondere Eigenschaften auf, wie z.B. die berühmte Dichteanomalie. Während die meisten Flüssigkeiten sich beim Abkühlen zusammenziehen, dehnt sich Wasser (bei Normaldruck) unterhalb von 4 °C wieder aus, die Dichte sinkt. Verglichen mit seiner Größe liegt auch der Siedepunkt von Wasser (100 °C) sehr viel höher als man erwarten würde.
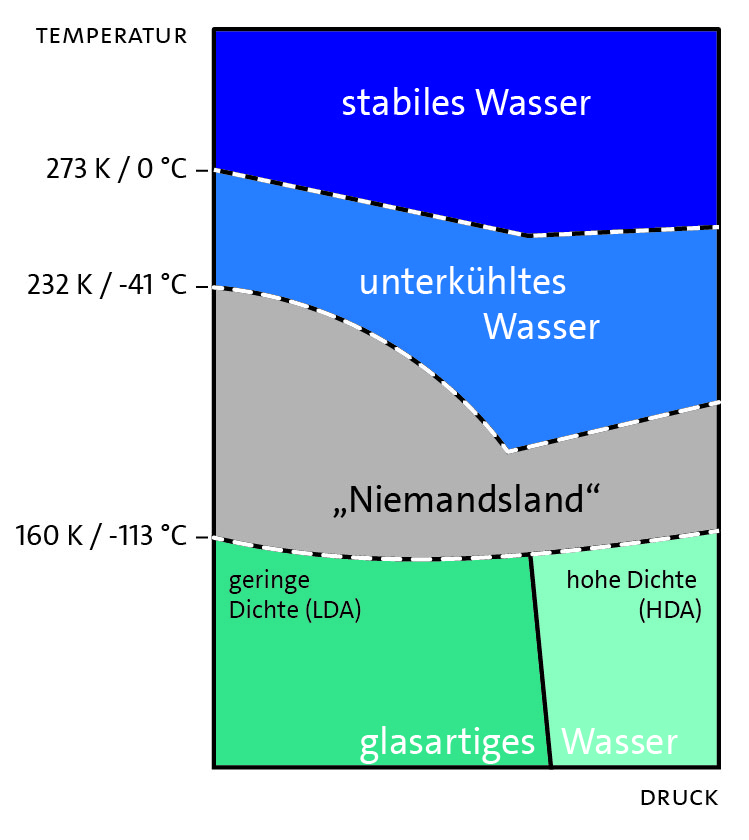
Wasser weist zahlreiche weitere Anomalien auf (ca. 60 sind aktuell bekannt), viele davon werden besonders im unterkühlten Zustand (je nach Druck im Temperaturbereich zwischen ca. 0 bis -100 °C und unter der Voraussetzung das keine Kristallisationskeime vorhanden sind, da sonst spontan die Bildung von Eis erfolgt) dominant. Senkt man die Temperatur noch weiter ab, erreicht man im Phasendiagramm (Abbildung 3) zunächst das sogenannte „Niemandsland“, metastabiles flüssiges Wasser, dass experimentell bisher nur schwer untersucht werden kann, da Wasser hier spontan, auch ohne Kristallisationskeim kristallisiert. Dringt man zu noch tieferen Temperaturen vor (ungefähr ab -113 °C), kann man, je nach Druck, glasartige, niedrig- bzw. hochdichte amorphe Eisformen erreichen.
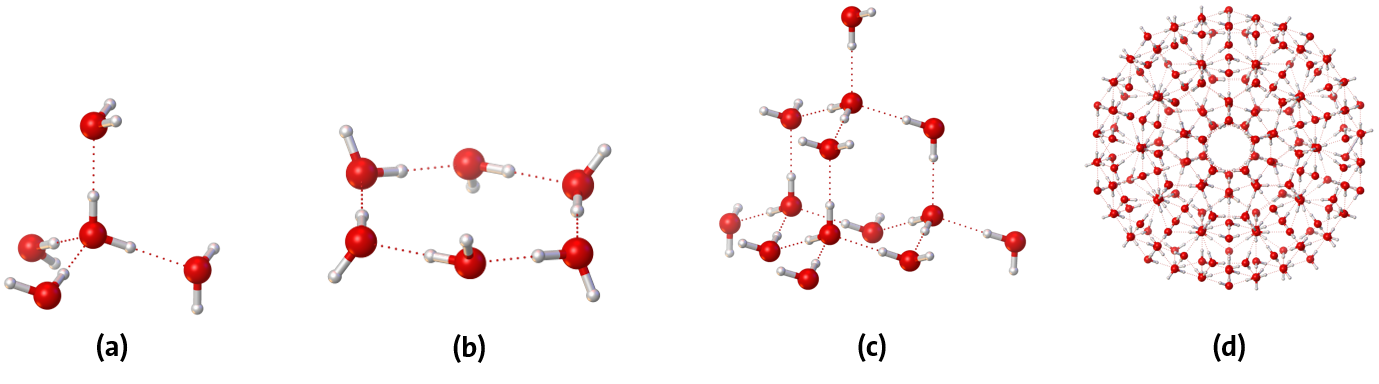
Kern all dieser Phänomene, der Eigenschaften von Wasser im Allgemeinen, sind, neben dem Dipolmoment des Moleküls, die sogenannten Wasserstoffbrückenbindungen, bei denen es sich um eine intermolekulare Wechselwirkung zwischen einem Wasserstoffatom des einen Wassermoleküls mit dem Sauerstoffatom eines benachbarten Wassermoleküls handelt. Ein einzelnes Wassermolekül kann dabei bis zu vier Wasserstoffbrückenbindungen in tetraedrischer Koordination ausbilden (Abbildung 4 (a)) und verfügt so auch über die Fähigkeit dreidimensionale Netzwerke auszubilden.

Je nach Druck- bzw. Temperaturbereich (und dem damit verbundenen Aggregatzustand) sind zahlreiche zwei- und dreidimensionale Strukturen, verschieden großer Cluster aus Wassermolekülen nachgewiesen worden. In der Gasphase kennt man vor allem Käfige, Ringe und Prismen. Eis zeigt einen ausgeprägten Polymorphismus, in Abhängigkeit von Druck- und Temperatur sind bisher 17 verschiedene kristalline, plus die zwei amorphen (oben bereits benannten) Formen bekannt. Eine allgemein bekannte Modifikation ist das Eis Ih, z.B. in Form von Schneeflocken, die hexagonale Symmetrie der Kristallstruktur spiegelt sich hier in der äußeren, sechseckigen Gestalt der Eiskristalle wider (Abbildung 5).
In flüssigem Wasser liegt, vereinfacht dargestellt, ein raumerfüllendes Netzwerk aus Wassermolekülen vor, das bestrebt ist, möglichst, die energetisch bevorzugte, tetraedrisch angeordnete Struktur auszubilden. Bei diesen typischen Clustern, handelt es sich um tetraedrische (H2O)14-Cluster, die dann noch größere Einheiten, wie z.B. ikosaedrische (H2O)280-Cluster aufspannen (Abbildung 4, (c) bzw. (d)). Es handelt sich dabei aber stets um ein dynamisches Netzwerk, die Wasserstoffbrückenbindungen werden ständig getrennt und neue geknüpft. Eine Wasserstoffbrücke existiert dabei im zeitlichen Mittel nur für wenige Pikosekunden, wobei die strukturelle Dynamik innerhalb des Wasserstoffbrückennetzwerks sogar bis auf die Zeitskala weniger Zehntel von Pikosekunden hinabreicht.
Wasser liegt aber nicht nur frei und in größeren Volumina, sondern häufig auch räumlich beschränkt, in nanoskaligen, porenähnlichen Geometrien, vor.
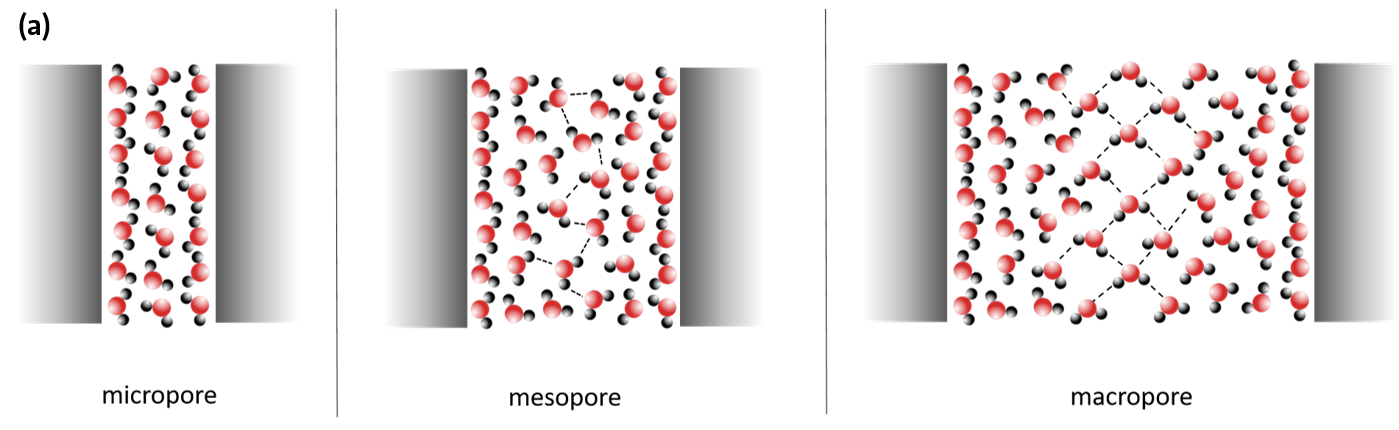
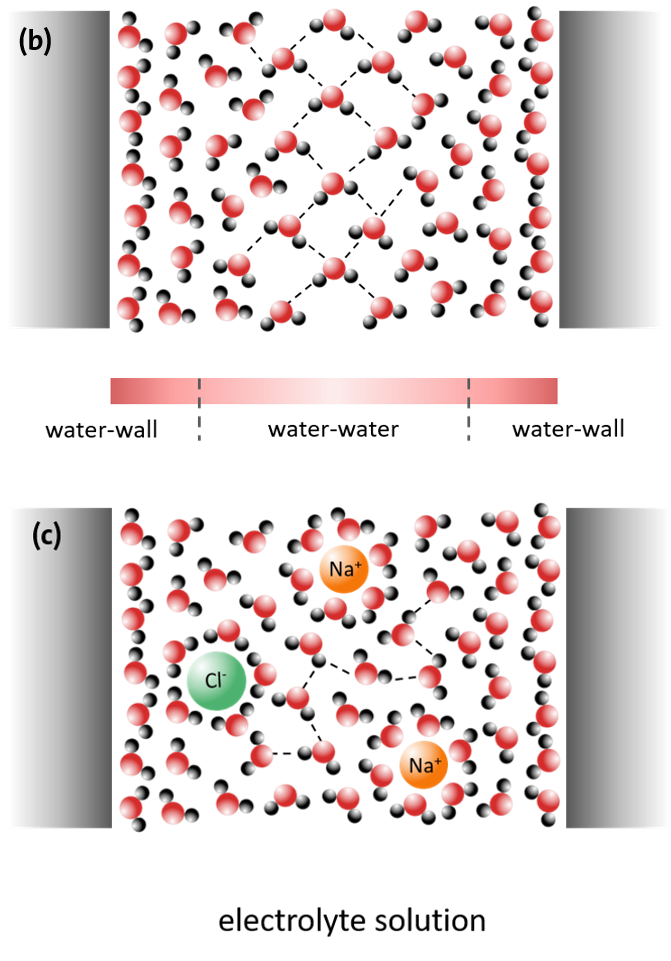
Die Eigenschaften von Wasser werden dann einerseits sehr stark von der räumlichen Ausdehnung der geometrischen Beschränkung und andererseits von den jeweils lokal vorliegenden Wechselwirkungen mit der Oberfläche der Beschränkung, wie z.B. einer Porenwand, bestimmt. Der sogenannte Confinement-Effekt tritt bei Porendurchmessern von unter 10 nm auf. In Abhängigkeit von der Art der Beschränkung, der Wechselwirkung mit der Porenoberfläche und ggf. im Wasser gelösten Substanzen (Elektrolyte) werden die physikalischen und chemischen Eigenschaften des Wassers dadurch dann stark verändert (Abbildung 6).
Dieses gegenüber dem Volumensystem deutlich geänderte Verhalten des Wassers spielt z.B. in vielen biologischen Prozessen, wie der Proteinfaltung, in Lab-on-a-Chip-Systemen, in der Löslichkeit von Gasen oder der heterogenen Katalyse eine wichtige Rolle. Die Kristallisation von Eis oder gelösten Salzen unter beschränkten geometrischen Bedingungen ist außerdem einer der wichtigsten Schadensprozesse bei der natürlichen Gesteinsverwitterung oder in verschiedensten Baumaterialien (historische und moderne Bauwerke und Baukonstruktion wie Brücken und Tunnel). Daneben bestimmen die Phasengleichgewichte von Wasser und wässrigen Elektrolytlösungen den Existenzbereich von flüssigem Wasser unter extremen klimatischen Bedingungen, beispielsweise auf dem Mars. Da flüssiges Wasser als Grundvoraussetzung für die Entwicklung von Lebensformen angesehen wird, ist die Kenntnis solcher Gleichgewichte von großer Bedeutung.
Trotz der enormen Relevanz von Wasser und wässrigen Lösungen, ist aber bisher wenig über diese zugrundeliegenden Prozesse und den Einfluss beschränkter Geometrien auf die Thermodynamik und Strukturdynamik des Wassers/der Wasserstoffbrückenbindungen bekannt. Das überrascht insbesondere, da es diesbezüglich bereits viele Erkenntnisse für einfache molekulare Fluide, wie lineare Kohlenwasserstoffe, gibt und molekulardynamische Studien u.a. auch auf deutliche Änderungen der elektrischen Polarisierbarkeit von Wasser in grenzflächenbestimmten Geometrien, insbesondere in Nanoporen hinweisen. Die hier vorgestellte Forschergruppe wird versuchen einige der offenen Fragen zu den Eigenschaften von Wasser in Nanoporen zu beantworten. Details zu den konkreten Fragestellungen und Teilprojekten finden Sie hier.
