DFG-Projekt: inCELLphosTAG (Prof. Meier, Fraunhofer, Perkin Elmer)
22. August 2019, von Chris Meier
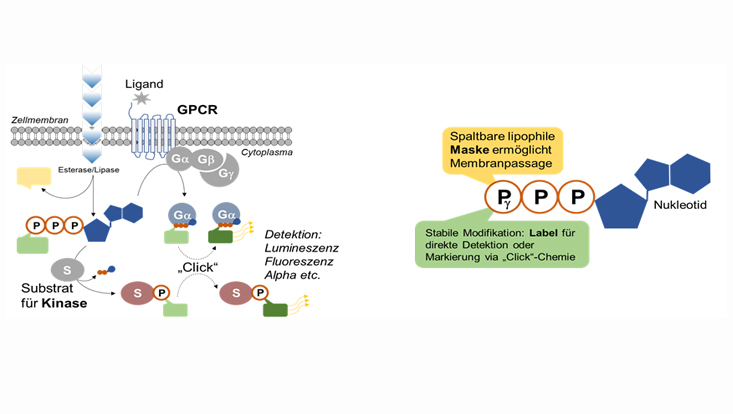
Foto: UHH/Meier
Für die erfolgreiche Arzneimittelforschung braucht es Werkzeuge und Techniken, mit denen die grundlegenden Vorgänge in menschlichen Zellen untersucht werden können, angefangen in Testsystemen, wie in der Zellkulturschale im Labor. Nur so kann es gelingen, wirksame Arzneistoffe zu entwickeln - Stoffe, die gegen Krankheiten eingesetzt werden, um in fehlerhafte und schädliche Vorgänge einzugreifen.
Arzneistoffe, seien es kleine Moleküle, Peptide, Oligonucleotide oder Antikörper, müssen am Anfang ihrer Entwicklung ihre Wirksamkeit in diesen Testsystemen beweisen. Dabei gilt es, möglichst genau die „physiologische“ Situation abzubilden. Nur dann ist die Chance gegeben, dass die langwierige und kostenintensive Arzneistoffentwicklung schließlich ein wirksames Medikament hervorbringt. Für viele Untersuchungen mangelt es bisher an ebensolchen, physiologisch relevanten Testsystemen und es kommen Systeme zu Einsatz, die verfügbar, jedoch weit ab von der „realen“ Situation sind. Als Folge kann es zu spektakulären, kostenintensiven Misserfolgen von Medikamentenkandidaten in späteren Phasen der klinischen Erprobung kommen.
Ziel dieses gemeinsam durch die Deutsche Forschungsgemeinschaft und die Fraunhofer-Gesellschaft mit 356 T€ geförderten Projekts ist es, in den nächsten drei Jahren eine Assay-Technologie zu entwickeln, die die Erforschung wichtiger zellulärer Vorgänge und Angriffspunkte von Arzneistoffen in relevanten Zellsystemen ermöglicht. Die Technologie soll schließlich auf sensitive, reproduzierbare und präzise Weise Daten und Erkenntnisse über die wichtigsten Zielklassen von Medikamenten liefern – darunter G-Protein gekoppelte Rezeptoren (GPCRs) und Proteinkinasen (PKs), auf die 30% bzw. 6% der vermarkteten Arzneimittel ausgerichtet sind.
Betrachtet man bisher verfügbare Assay-Technologien, so nutzen diese meist radioaktiv markierte Reagenzien als Werkzeuge, welche eine Reihe von Problemen mit sich bringen. Zudem sind diese Reagenzien nicht in der Lage, intakte Zellmembranen zu durchqueren, können also nicht für Hochdurchsatz-Untersuchungen von GPCRs und PKs in lebenden Zellen genutzt werden.
Unser Konsortium vereint einzigartige Expertise in der Herstellung zellpermeabler, chemisch veränderter Nukleosidtriphosphate (NTPs), bekannt als TriPPPro-Technologie (Universität Hamburg, Organische Chemie, Prof. Dr. Chris Meier) mit umfangreicher Erfahrung in der Entwicklung und Anpassung zellbasierter Untersuchungsmethoden für Hochdurchsatz-Screening-Kampagnen und der Anwendung von physiologisch relevanten humanen induzierten pluripotenten Stammzellen (hiPSC) in frühen Phasen der Medikamentenforschung (Target-to-Lead Drug Discovery) (Fraunhofer IME ScreeningPort, Dr. Ole Pless). Diese bietet das Potenzial, bisher vorhandene Reagenzien durch solche zu ersetzen, die erstmals in lebenden, physiologisch relevanten Testsystemen eingesetzt werden können und dabei ohne radioaktive Markierung auskommen. Darüber hinaus haben wir Zugang zu modernster Screening-Technologie, zu mehreren 100.000 "ready-to-screen"-Testsubstanzen und bringen mit unserem Industriepartner das Wissen und die Erfahrung eines der weltweit führenden Unternehmen ein, welches Assay-Technologien für alle großen Pharmaunternehmen anbietet (PerkinElmer Inc., Dr. Vincent Dupriez).
Abschließendes Ziel dieses von 2019-2022 laufenden Projekts ist es daher, diese neuartige Technologie zur Marktreife zu entwickeln und diese mittelfristig in kommerziellen "ready to use"-Kit-Formaten einzuführen. So kann sie breiten Einsatz finden und sowohl die Grundlagenforschung zur Aufklärung der Krankheitsmechanismen befruchten als auch die industrielle Arzneimittelforschung vorantreiben. Mit unseren Arbeiten wollen wir so die Medikamentenforschung auf verschiedenen Ebenen unterstützen.


