Wie ein Penicillin-Killer ausgeschaltet wird
5. August 2024, von Prof. Dr. Dr. Christian Betzel
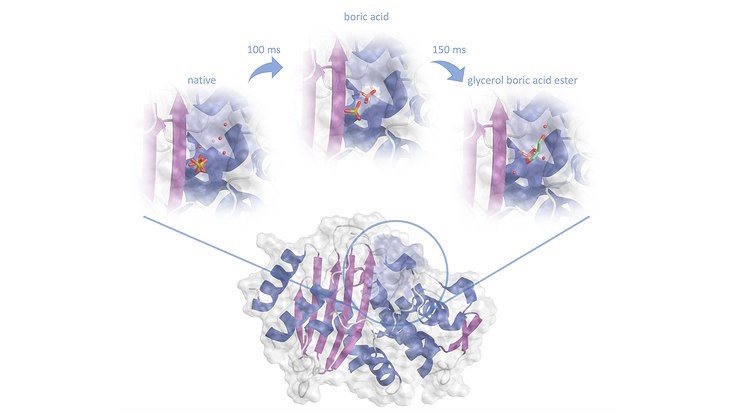
Foto: C. Betzel
Ein Forschungsteam von Wissenschaftlern der Universität Hamburg, unter Leitung von Prof. Betzel, Wissenschaftlern des DESY und des Universitätsklinikums Hamburg-Eppendorf (UKE) hat über innovative Methoden der seriellen Röntgenkristallstrukturanalyse die Inhibierung einer Laktamase, aus einem multiresistenten Bakterium bei atomarer Auflösung zeitaufgelöst analysiert. Laktamasen aus multiresistenten Keimen können die meistbekannte Klasse von Antibiotika, zu denen z.B. auch die penicillin-ähnlichen Antibiotika gehören außer Kraft setzen in dem Sie den zentralen Ring des Beta-Laktam-Moleküls spalten und damit dessen antibiotische Eigenschaften tilgen. Wissenschaftler:innen auf der ganzen Welt sind daher auf der Suche nach neuen und effizienten Wirkstoffen zur Behandlung von bakteriellen Infektionen die insbesondere durch multiresistente Bakterien verursacht werden – also Bakterien, die gegen mehrere Antibiotika widerstandsfähig sind. Im Fokus stehen Bemühungen penicillin-ähnliche organische Verbindungen zu finden die in das aktive Zentrum der Beta-Laktamasen eindringen und es blockieren, wissend dass die Bakterien auch gegen diese Substanzen in wenigen Jahren Resistenzen entwickeln werden. Das Team der Wissenschaftler hat daher einen anderen Ansatz gewählt, um die Penicillin-Killer auszuschalten, in diesem Fall basierend auf Borsäure. Medizinerinnen und Mediziner nutzen bereits borhaltige Verbindungen erfolgreich, z.B. für die Behandlung einer Form von Blutkrebs. „In Vorexperimenten, die auch am EuXFEL durchgeführt wurden, konnten wir feststellen, dass diese Substanzen auf Borsäurebasis auch sehr gut Beta-Laktamasen inhibieren“, sagt Andreas Prester, Erstautor der Studie, kürzlich am Fachbereich Chemie ausgezeichnet für seine herausragende Promotionsarbeit und derzeit Postdoc am UKE. Prester und seine Kollegen, Markus Perbandt von der Universität Hamburg, Winfried Hinrichs, emeritierter Professor der Universität Greifswald, haben im Team mit der AG Betzel die Hemmung durch Borsäure im Detail untersucht. Für zeitaufgelöste Strukturuntersuchungen wurde ein von Dr. Dominik Oberthür, ehemaliger Doktorand am Fachbereich Chemie, entwickelter Messaufbau an der PETRA III-Messstation P11 genutzt und die Bindung der Borsäure mit msec Zeitauflösung über die Methode namens „mix and inject serial crystallography“ an die Aminosäure Serin im aktiven Zentrum des Enzyms wie in einen Film dargestellt. Das Forschungsteam fand auch heraus, dass sowohl Borsäure als auch Borsäure in Verbindung mit einem organischen Molekül gleich schnell an das Enzym bindet. Das Ergebnis: „Die Bindung zwischen Borsäure und der Aminosäure Serin im aktiven Zentrum der Laktamase ist relativ stabil. Damit verhindert die Borsäure, dass das Enzym mit dem Antibiotikum interagieren kann“, sagt Prester. Die Art der Verbindungen, die vom Forschungsteam eingesetzt haben, und die entsprechenden chemischen Reaktionen, die zeitlich aufgelöst beobachtet wurden sind sehr weit von bisherigen penicillin-ähnlichen Hemmstoffen entfernt, gegen die viele Bakterien heute bereits resistent sind. Im Vergleich dazu ist Borsäure ein sehr kleines Molekül. Auch wenn es dadurch nicht ganz so effizient ist wie andere Hemmstoffverbindungen, ist es gleichzeitig sehr unwahrscheinlich, dass die Bakterien in naher oder ferner Zukunft eine Resistenz gegen Borsäure entwickeln. Sollte sich die Borsäure vom Enzym lösen, kann ein anderes Borsäuremolekül - oder sogar dasselbe - aufgrund seiner geringen Größe und Stabilität leicht wieder eindringen und die aktive Stelle erneut blockieren. Die Ergebnisse öffnen und unterstützen neue und innovative Möglichkeiten und Wege Medikamente gegen Antibiotika-Killer zu entwickeln und damit die Wirksamkeit vorhandener Antibiotika zu erhalten. Diese Studie veröffentlichten die Forschenden im renommierten Fachmagazin „Nature Communications Chemistry“.
Originalveröffentlichung
"Time-resolved crystallography of boric acid binding to the active site serine of the β-lactamase CTX-M-14 and subsequent 1,2-diol esterification". Andreas Prester, Markus Perbandt, Marina Galchenkova, Dominik Oberthür, Nadine Werner, Alessandra Henkel, Julia Maracke, Oleksandr Yefanov, Johanna Hakanpää, Guillaume Pompidor, Jan Meyer, Henry Chapman, Martin Äpfelbacher, Winfried Hinrichs, Holger Rohde & Christian Betzel. Nature Communications Chemistry 2024, DOI:10.1038/s42004-024-01236-w


